En física, la energía interna (U) de un sistema intenta ser un reflejo de la energía a escala microscópica. Más concretamente, es la suma de:
la energía cinética interna, es decir, de las sumas de las energías cinéticas de las individualidades que lo forman respecto al centro de masas del sistema, y de
la energía potencial interna, que es la energía potencial asociada a las interacciones entre estas individualidades.[1]
La energía interna no incluye la energía cinética traslacional o rotacional del sistema como un todo. Tampoco incluye la energía potencial que el cuerpo pueda tener por su localización en un campo gravitacional o electrostático externo.
Primera ley de la termodinámicaArtículo principal: Primera ley de la termodinámica
También conocida como principio de conservación de la energía para la termodinámica «en realidad el primer principio dice más que una ley de conservación», establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará. Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Nicolas Léonard Sadi Carnot en 1824, en su obra Reflexiones sobre la potencia motriz del fuego y sobre las máquinas adecuadas para desarrollar esta potencia, en la que expuso los dos primeros principios de la termodinámica. Esta obra fue incomprendida por los científicos de su época, y más tarde fue utilizada por Rudolf Loreto Clausius y Lord Kelvin para formular, de una manera matemática, las bases de la termodinámica.
Donde U es la energía interna del sistema (aislado), Q es la cantidad de calor aportado al sistema y W es el trabajo realizado por el sistema.
∆U = Q + W.
Preguntas
¿Qué le ocurre a la energía interna por el calor? Ejemplos de cambio de energía interna por calor ¿Qué le ocurre a la energía interna por el trabajo? Ejemplos de energía interna por trabajo ¿Cómo se define la primera ley de la termodinámica? Expresión matemática de la primera ley de la termodinámica
Equipos 4 2 3 1 6 5
Respuestas Al aumentar la temperatura de un sistema sin que varié nada mas aumenta su energía interna reflejado en el aumento de calor del sistema completo. Cuando se calienta el agua aumenta la energía interna. lml Pueden ser choques o acciones ejercidas a distancia mediante partículas dotadas de movimiento de diferentes tipos como vibración, rotación y traslación. Se refiere al concepto de energía interna, trabajo y calor. Dice que si sobre un sistema con determinada energía interna se realiza un trabajo mediante un proceso, la energía interna del sistema variará. U= Q-W
U= energía interna del sistema aislado
Q= cantidad de calor aportado al sistema
W= trabajo realizado por el sistema.
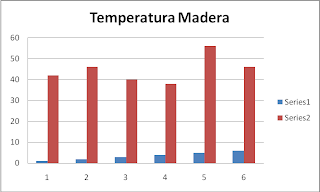
Equipo Temperatura madera Metal Piedra
1 42° 34° 38°
2 46° 32° 44°
3 40° 38° 32°
4 38° 34° 44°
5 56° 34° 48°
6 46° 32° 40°
Graficar los datos para cada material (equipo-temperatura).

No hay comentarios:
Publicar un comentario